Ошлянська О. А., Охотнікова О. М.
Національний університет охорони здоров’я України імені П. Л. Шупика, м. Київ
Першоджерело: Журнал АЛЕРГІЯ У ДИТИНИ 27/28 2021
Лікар завжди мусить передбачувати результати дії ліків…
Це передбачення стосується не тільки позитивного ефекту, але навіть негативного, як кажуть, «побічної дії»
В.Х. Василенко, терапевт, академік АМН СРСР
Ще у 1929 році Хенч звернув увагу на те, що в одного хворого на ревматоїдний артрит (РА) настало різке поліпшення в період захворювання на жовтяницю, в іншому випадку спостережене поліпшення перебігу хвороби під час вагітності, що було пояснено викидом ≪антиревматичної субстанції Х≫. В результаті її пошуків Хенч і Кендал дійшли висновку про можливу протизапальну роль похідних кортикостерону.
21 вересня 1948 року хворому на РА з лікувальною метою вперше було здійснено ін’єкцію великої дози кортизону, що розпочало сучасну еру глюкокортикостероїдної (ГКС) терапії.
Рецептори до ГКС наявні практично на всіх клітинах людського організму, що пояснює як плейотропність фармакологічної дії цих препаратів, так і неминучість розвитку їхніх небажаних ефектів у разі тривалого системного застосування. Звідси і перебільшена обережність окремих клініцистів до призначення цих препаратів, і ≪гормонофобія≫ батьків маленьких пацієнтів.
Проте протягом майже 70 років від першого введення ГКС залишаються найпотужнішими з протизапальних засобів.
Основним представником ГКС в організмі людини є кортизол. Продукт його метаболізму (кортизон) був першим штучним синтезованим ГКС, що став початковою базою для синтезу багатьох похідних, лише незначна частка з яких знайшла застосування в рутинній педіатричній практиці (рис. 1).
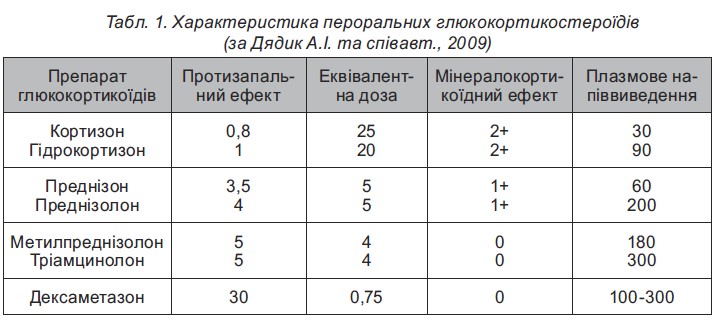
На сьогодні існує численна кількість синтезованих молекул ГКС. Незважаючи на спільність основних фармакологічних ефектів, їхня дія дещо відмінна у різних препаратах ГКС (табл. 1).
Механізм дії ГКС багатогранний. Їхній протизапальний ефект пов’язаний зі стабілізацією біологічних мембран. Стабілізація лізосомальних мембран у разі застосуванні ГКС відбувається шляхом гальмування перекисного окислення ліпідів і веде до обмеження викиду різних протеолітичних ензимів за межі лізосом, що запобігає деструктивним процесам у тканинах і зменшує запальні реакції (рис. 2).
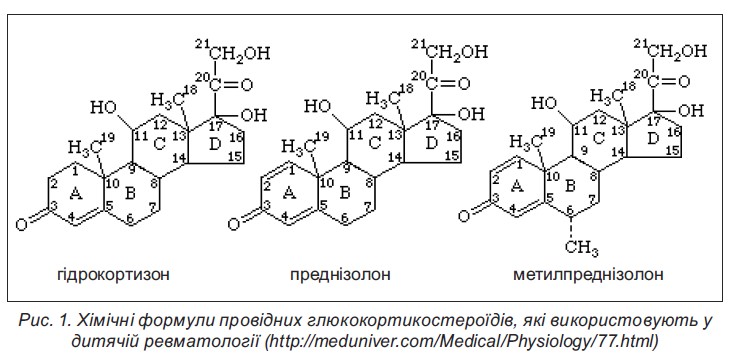
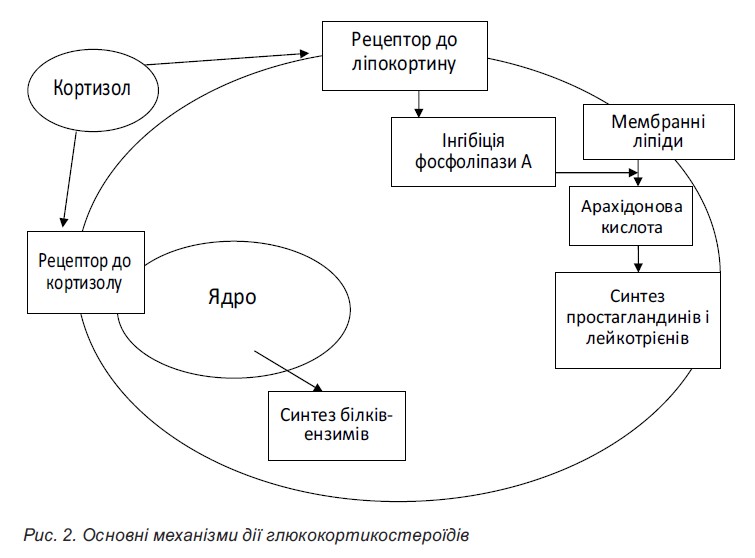
На відміну від інших протизапальних засобів, у ГКС виражена й антипроліферативна дія. ГКС пригнічують проліферацію фібробластів і синтез колагену, а отже, і склеротичні процеси в цілому.
Імуносупресивний ефект ГКС залежить від вибіркового гальмування функції і розвитку імунокомпетентних лімфоїдних клітин. Під впливом ГКС у тимусі відбувається руйнування утворених середніх і малих лімфоцитів, пригнічення подальшого утворення антитіл і ЦІК.
ГКС індукують утворення ліпокортинів, які мають протинабрякову активність, у відносно великих дозах вони гальмують розвиток лімфоїдної і сполучної тканин, пригнічують активність гіалуронідази та сприяють зменшенню проникності капілярів. Під впливом ГКС затримується синтез і прискорюється розпад білків.
Зазначені ефекти досягаються завдяки як геномній, так і негеномній дії ГКС.
Негеномні ефекти ГКС розвиваються протягом секунд і хвилин, до них належать:
- Посилення синтезу протизапальних білків (ліпокортини-1 пригнічують активність фосфоліпази А-2), інгібіція секреторної лейкоцитарної протеази (SLPI), триптази; синтез ІЛ-10, антагоніста рецептора до ІЛ-1 (ІЛ-1 Ra); нейтральних ендопептидаз – ферментів, що беруть участь у руйнуванні брадикініну і тахікінінів).
- Посилення експресії β2-адренорецепторів. Геномні ефекти ГКС відбуваються повільніше – протягом годин. Серед них найбільш важливі такі:
І. Пригнічення продукції прозапальних цитокінів (ІЛ-1; ФНП-α; гранулоцитарномакрофагального колонієстимулювального фактору; ІЛ-2; ІЛ-3; ІЛ-4; ІЛ-5; ІЛ-6; ІЛ-11; ІЛ-8) та інших месенджерів запалення – RANTES; МСР-1; МСР-3; еотаксину.
- Інгібіція запальних ферментів (NО-синтетази, індуцибельної циклоксигенази-2 тощо).
III. Вплив на клітинні рецептори (наприклад, зменшення продукції та експресії ІЛ-lrII).
- Пригнічення продукції ІЛ-5 та колонієстимулювальних факторів сприяє зменшенню тривалості життя імунокомпетентних клітин.
- Зменшення експресії молекул адгезії (ICAM-1, Е-селектину тощо).
Залежно від тривалості пригнічення синтезу адренокортикотропного гормону (АКТГ), яке викликане стандартною дозою (еквівалентною 50 мг преднізону), всі ГКС умовно можуть бути розподілені на три групи:
- ГКС короткої дії (гідрокортизон, кортизон, дефлазакорт), які пригнічують дію АКТГ менше, ніж на 36 годин;
- ГКС проміжної дії (преднізон, преднізолон, метилпреднізолон, триамцинолон), які пригнічують АКТГ протягом приблизно 48 годин;
- ГКС тривалої дії (дексаметазон, бетаметазон), які пригнічують AКТГ більше, ніж на 48 годин.
З огляду на геномий механізм дії ГКС зрозуміло, що тривалість їх ефекту безпосередньо не корелює з часом напіввиведення гормону з плазми. Наприклад, у кортизолу і дексаметазону (з плазмовим напіввиведенням 90 і 100 хвилин відпоідно) є зовсім інший біологічний термін
життя в тканинах, що становить 8-12 годин для кортизолу і 36-54 годин для дексаметазону.
Використання ГКС у лікуванні ревматичних захворювань (РЗ) базується на їх виразній протизапальній та імуносупресивній дії.
Головними показаннями до призначення ГКС у разі РЗ у дітей є:
- висока клініко-лабораторна активність захворювання;
- специфічне автоімунне ураження окремих органів і систем (очей, нирок,серця, ендокринних залоз, нервової системи);
- гострі імунні кризи.
Існують особливості показань до призначення ГКС при різних нозологічних одиницях.
Окрім того, ГКС обов’язково призначаються дітям з РЗ і вторинною наднирковою недостатністю як замісна терапія, у разі алергічних ускладнень у процесі лікування, за розвитку небажаних ефектів базової хворобо-модифікуючої терапії (БХМТ) (цитопенія, гепатит, тощо), коли зберігається активність хвороби та неможливо продовжити БХМТ.
Правильним методом призначень ГКС у ревматологічній практиці вважається застосування на початку курсу лікування більш великих доз гормонів (адекватно щодо активності конкретної хвороби) з їх подальшим поступовим зниженням і відміною за можливості. Дози і темпи їх зниження у разі різних РЗ значно різняться; неоднакові також реакції організму на припинення ГКС-терапії. ГКС можна призначати в комбінації з іншими антиревматичними препаратами, а за необхідності – з будь-якими іншими лікарськими засобами.
Глюкокортикоїдна терапія РЗ може бути:
- локальною (внутрішньосуглобове застосування);
- місцевою (зовнішньою – у вигляді мазей, аплікацій, введення шляхом фоно- та електрофорезу);
- системною (пероральна і парентеральна).
Локальна та місцева ГКС-терапія використовується переважно у дітей з ураженнями суглобів.
У великі суглоби (колінний, плечовий, гомілковий) може бути введено 1 мл (40 мг) метилпреднізолону або 1 мл (7 мг) бетаметазону, у середні (ліктьові, променево-зап’ясні –максимально 0,5-0,7 мл, у дрібні – 0,1-0,2 мл. Введення ГКС у кульшові суглоби НЕ рекомендується, оскільки може розвинутися аваскулярний некроз голівок стегнових кісток. За потреби одночасного введення ГКС у кілька суглобів вважається доцільним вводити не більше 1 мл цього препарату загалом.
Особливості призначення ГКС в терапії ювенільного ідіопатичного артриту (ЮІА) наведені у таблиці 2.
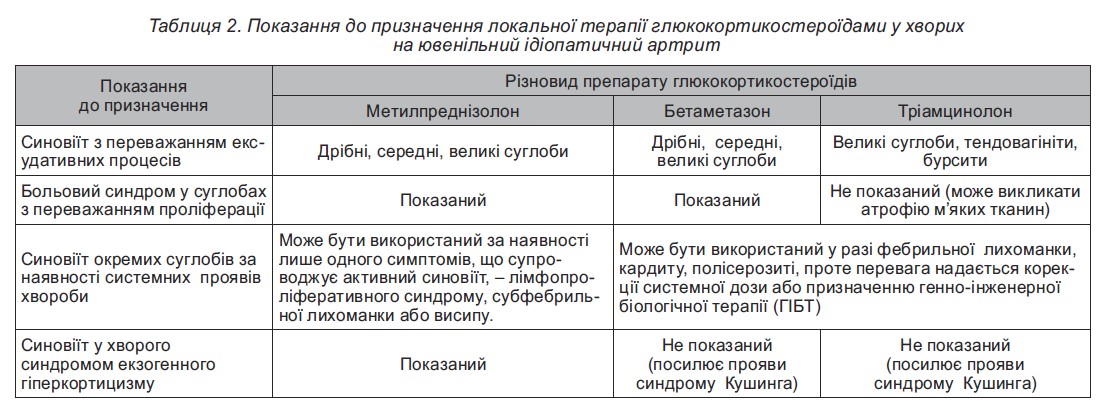
За недостатнього або короткочасного ефекту внутрішньосуглобового введення ГКС, ми маємо позитивний досвід застосування їхньої комбінації з інтраартикулярними ін’єкціями цитостатичних препаратів (циклофосфамід).
Потреба в частому (частіше 1 разу на місяць) інтраартивуклярному введенні ГКС, згідно наших спостережень, відображає неадекватність системної протиревматичної терапії і вимагає її корекції.
Локальне застосування ГКС протипоказане у разі:
- підозри на інфекційний (септичний процес) у первинних випадках або ускладнень лікування ЮІА;
- наявності геморагічного синдрому;
- неексудативного характеру артриту;
- виразній деформації суглобу (порушуються анатомічні співвідношення між суглобовими поверхнями (конгруентність суглобів) та підвищується ризик розвитку ускладнень);
- підозри або попереднього асептичного некрозу суглоботвірних кісток;
- відсутності або маловираженого ефекту від 2-ох попередніх уведень;
- великої кількості ≪активних≫ синовіїтів.
Слід пам’ятати, що часте, повторне інтраартикулярне введення ГКС призводить до збільшення періартикулярного остеопорозу, підсилює деструктивні зміни у хрящі, підвищує ризик розвитку інфекційних ускладнень і гіпотрофіі прилеглих тканин.
Нова редакція Національного протоколу передбачає можливість призначати ГКС внутрішньосуглобово у разі встановленні діагнозу ЮІА усім хворим. У пацієнтів з ураженням < 5 суглобів рекомендується призначати інтраартикулярно ГКС пролонгованої дії (тріамцинолон).
Використання внутрішньосуглобових ін’єкцій ГКС для лікування активного артриту рекомендовано незалежно від застосування БХМТ або генно-інженерної біологічної терапії (ГІБТ). Внутрішньосуглобові ін’єкції ГКС, які приведуть до клінічного поліпшення артриту, можна повторювати за необхідності принаймні 4 місяці. Скорочення тривалості клінічної відповіді може означати необхідність ескалації системної терапії.
Досі залишаються дискутабельними такі питання:
- Чи проводити інтраартикулярні введення ГКС за великої кількості ≪активних≫ синовіїтів, яка частота введень є оптимальною?
- Чи здатні внутрішньосуглобові введення ГКС викликати системну дію?
- Скільки попередніх таких уведень вважати критерієм недоцільності продовжити терапію з використанням виключно інтраартикулярних уведень ГКС?
- Чи доцільно вводити інтраартикулярно пролонговані препарати ГКС?
- Чи доцільно використовувати так звану ≪хімічну синовектомію≫?
У разі внутрішньом’язового і довенного введення середньотерапевтичних доз ГКС їх дія може бути більш короткочасною і в більшості випадків недостатньою для проведення тривалого лікування.
Оновлення рекомендацій EULAR з ведення хворих, які отримують ГКС проводилося багаторазово (2007-2010-1013 рр.). Проте рандомізовані клінічні дослідження (РКД), метою яких була оцінка ефективності, проведені лише у дорослих пацієнтів із системним червоним вовчаком (СЧВ), поліміалгіями, раннім РА, АНЦА-асоційованими васкулітами, а у разі системної склеродермії (ССД) вивчалася лише пульс-терапія ГКС.
Незважаючи на відсутність педіатричних досліджень у цьому напрямі, ГКС-терапія входить у всі відомі рекомендації, оцінка її ефективності базується на проспективних клінічних дослідженнях.
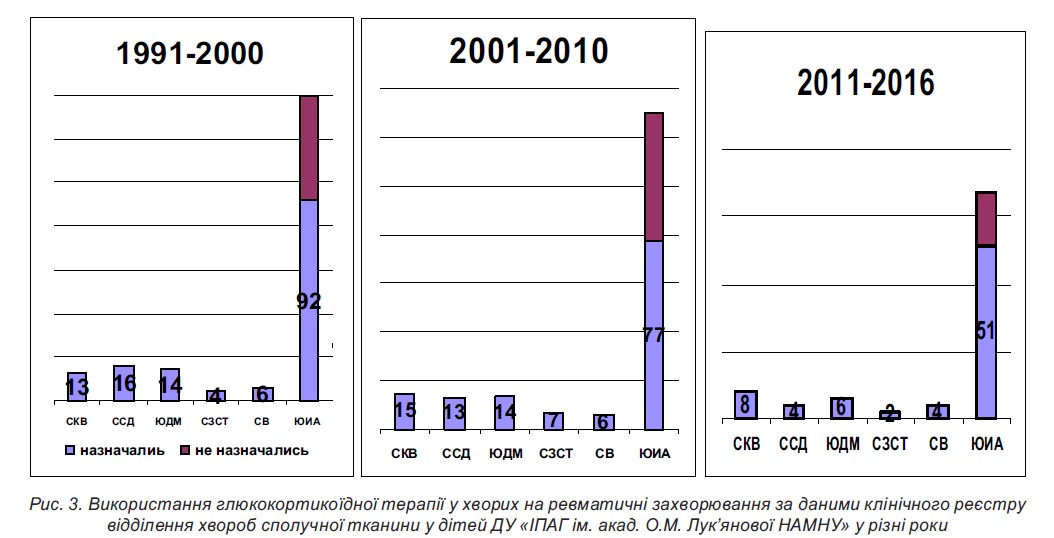
ГКС залишаються препаратами вибору при всіх системних захворюваннях сполучної тканини. У ДУ ≪ІПАГ ім. акад. О.М. Лук’янової НАМНУ≫ частота їх використання залишається значною (рис. 3).
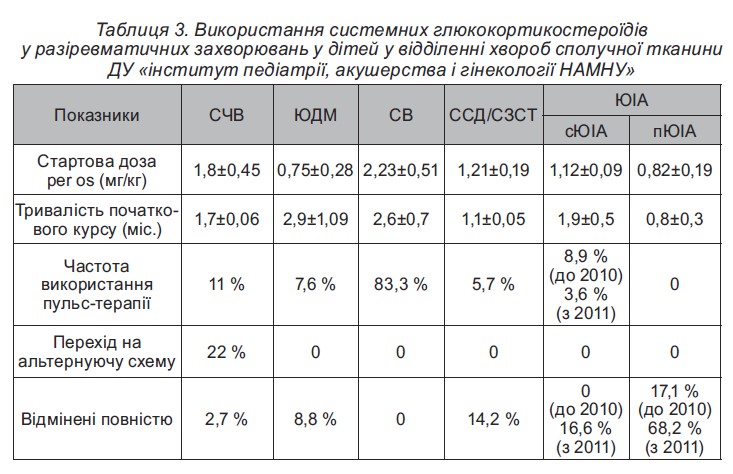
Аналіз даних клінічного реєстру засвідчив, що за тривалого застосування ГКС перевага віддавалася призначенню метилпреднізолону (87 % випадків), у решти хворих використовувався преднізолон, лише у 4 % дітей із СЧВ – дексазон. Системні ГКС призначалися як препарат першого ряду з метою мінімізації активності хвороби до досягнення ефекту БХМТ, а також при розвитку побічних ефектів БХМТ і за недостатньої ефективності та високого ризику розвитку небажаних подій терапії НПЗП у разі пЮІА та ювенільного спондилоартриту (ЮСА) (табл. 3).
В останні десятиліття у ревматологічній практиці набула поширення пульстерапія надвисокими дозами ГКС, для чого зазвичай застосовують метилпреднізолон (частіше солю-медрол), який уводять внутрішньовенно до 1 г / добу протягом 3 днів поспіль.
Найчастіше в дитячій ревматології застосовуються такі схеми пульс-терапії ГКС:
- класична пульс-терапія ГКС – 15-20 мг/кг метилпреднізолону (до 1000 мг/м2), що розчинені в 100-200 мл фізіологічного розчину або 5 % розчину глюкози за 30-60 хвилин протягом 3 днів. У дітей може використовуватися такий розрахунок дози ГКС: разова доза = 250 х площа поверхні тіла х індекс резистентності (ір) ір = 3 – 6 міс. неефективного лікування;
ір = 2 – 2 і більше загострень за 6 міс з короткими ремісіями;
ір = 1 – 1 загострення за попередні 6 міс.
- міді-пульс-терапія ГКС – використовується доза ГКС у 2 рази менша, ніж при класичній, міні пульс-терапія – у 4 рази менша.
- комбінована – у 2-й день додатково вводять циклофосфамід з розрахунку 15-20 мг/кг.
- синхронна: 3-5 сеансів плазмаферезу, після кожного з них проводиться введення метилпреднізолону, після 2-го сеансу – проводять введення циклофосфану (200-1000 мг).
З метою запобігання небажаним реакціям інфузія надвисоких доз ГКС може доповнюватися введенням у флакон 5000-10000 Од гепарину після введення димедролу і завершуватися введенням фуросеміду тощо.
Задля профілактики розвитку генералізованих інфекцій хворому додатково під час проведення ГКС-пульс-терапії можуть призначатися довенні імуноглобуліни й антибактеріальні препарати.
Повторні курси ГКС-пульс-терапії можуть проводитися тільки 1 раз на місяць.
Пульс-терапія ГКС не замінює перорального прийому ГКС, але дозволяє призначати їх в менших дозах і швидше зменшувати дозу до підтримувальної та запобіг розвитку ускладнень.
Пульс-терапія метилпреднізолоном досить добре переноситься дітьми. Основними небажаними її ефектами є тахікардія, гіперглікемія, підвищення артеріального тиску, артралгії, міалгії, гіперемія лиця, біль голови, запаморочення, зміна смаку, ейфорія.
У хворих на СЧВ показаннями для проведення ГКС-пульс-терапії можуть бути: висока активність процесу, кризові стани, неефективність стандартного дозування, виражені явища васкуліту, цереброваскуліт, ураження нирок з розвитком нефротичного синдрому. У таких випадках пульс-терапія проводиться досить часто (за даними власного дослідження – в 11 % хворих).
Менша ефективність ГКС-пульстерапії відзначається у хворих на ювенільний дерматоміозит (ЮДМ), що може бути зумовлена міопатичною дією самих ГКС. Показаннями для проведення пульстерапії у разі ЮДМ є: наростання дисфагії, розвиток альвеоліту, неможливість подолати міопатичний криз стандартними дозами ГКС.
У разі ЮІА пульс-терапія ГКС може бути проведена за наявності у хворого ревматоїдного васкуліту, особливо з розвитком нефриту, у разі наявності синдрому активації макрофагів (САМ), цитопенії і поліневропатії, плевриту, ураження легень або перикардиту.
Уніфікований клінічний протокол надання медичної допомоги хворим на ювенільний артрит (2012) передбачає можливість додатково призначати до пульс-терапії метилпреднізолоном при тяжких системних проявів у вигляді васкуліту, пневмоніту, кардиту, полісерозиту, тромбоцитопенії підшкірне введення метотрексату у дозі 15-20 мг/м2 (Бережний В.В. і спіавт., 2003). Останнім часом здійснено вдалі спро би створити парентеральні ГКС пролонгованої дії: бетаметазон (целестон) і тріамцінолон (кеналог). Основним методом лікування ГКС у ревматологічній практиці залишається пероральний прийом ГКС-препаратів. При цьому слід враховувати, що за активністю таблетки кожного з ГКС-засобів приблизно еквівалентні. Одна таблетка преднізолону і преднізону містить 5 мг, тріамцинолону і метилпреднізолону (урбазону) – 4 мг, дексаметазону (дексазону) і бетаметазону – 0,75 мг. Отже, за необхідності заміни одного препарату іншим слід користуватися правилом: ≪таблетка за таблетку≫. У медичній літературі при описі доз і схем лікування розрахунок йде на преднізолон.
Тривале пероральне застосування низьких і середніх доз ГКС у педіатричній практиці має певні особливості.
- У дітей застосовують тільки синтетичні препарати з проміжним періодом напіввиведення – це преднізолон і метилпреднізолон.
- Пероральні ГКС є препаратами вибору у разі системних варіантах ЮІА, СЧВ, ЮДМ, системних васкулітах.
- Перевага надається ≪низьким≫ (< 7,5 мг/д у перерахунку на преднізолон) та ≪середнім≫ (7,5-30 мг/добу) дозам.
- Після мінімізації активності захворювання та досягнення ефекту БХМТ рекомендується максимально знизити дозу (за можливості до повної їх відміни).
Рекомендована тактика відміни пероральних ГКС:
- Категорично протипоказане повна відміна ГКС, які призначені в дозі 1 мг/кг/добу за преднізолоном і вище протягом 2-4 місяців після досягнення терапевтичного ефекту.
- Підтримувальну дозу (5-10 мг/добу за преднізолоном) дитина повинна отримувати не менше 6 місяців.
- Швидкість зниження дози ГКС визначається початковою добовою дозою. За початкової дози преднізолону 15 мг/добу і більше рекомендоване її зниження по 1,25 мг 1 раз на 3-4 дні, при зниженні вихідної дози з 15 до 10 мг/добу – по 1,25 мг 1 раз на 5-7 днів. За вихідної дози з 10 до 5 мг/добу слід зменшувати по 1/2 таблетки через день (протягом 5 днів дитина перебуває на інтермітуючому режимі лікування, тобто отримує у парні дні певну дозу препарату, а в непарні – вона знижується на 1/2 таблетки). За відсутності синдрому відміни протягом наступних 5 днів дитина постійно приймає початкову дозу препарату (без 1/8 таблетки). За зниження дози з 5 мг/добу до повного скасування рекомендується зменшувати дозу не більше 1/2 таблетки 1 раз на 1,5-2 місяці (по 2 тижні інтермітуючого прийому, потім 4 тижні постійного прийому в новому дозовому режимі аж доповної відміни).
Інтермітуюча схема прийому ГКС може бути рекомендована на тривале застосування підтримувальної дози (за відсутності скарг в день прийому меншої дози або відсутності прийому препарату), що дозволяє зберегти функцію власних надниркових залоз і зменшує ризик розвитку небажаних подій тривалого лікування ГКС.
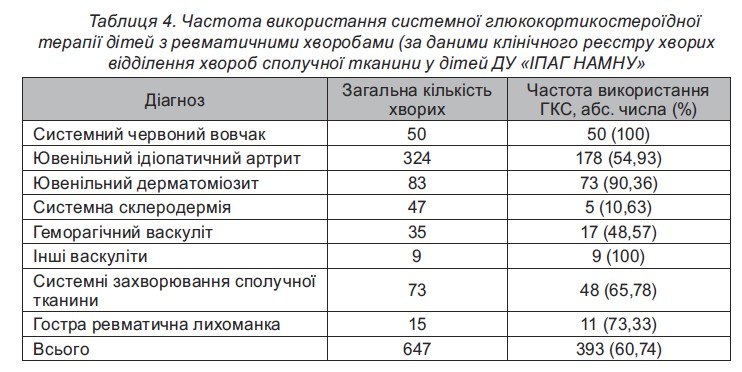
Незважаючи на суттєве зменшення системного призначення ГКС в останні роки, у клінічний реєстр відділення захворювань сполучної тканини у дітей ДУ ≪ІПАГ ім. акад. О.М. Лук’яновоїНАМНУ≫ за останні20 років внесена численна кількість випадків ентерального та парентерального їх використання у лікуванні РЗ (табл. 4).
Існують певні особливості призначення системних пероральних ГКС при різних РЗ у дітей.
У разі ЮІА використовуються нижчі дози ГКС, які завжди призначаються на тлі БХМТ.
Уніфікованим клінічним протоколом медичної допомоги дітям, хворим на ювенільний артрит (2012), значне місце відведене більш ранньому використанню засобів біологічної терапії і суттєво обмежені показання для перорального призначення ГКС.
Дітям з низькою активністю системного ЮІА (активна лихоманка при оцінці лікарем і пацієнтом < 7) за відсутності факторів несприятливого прогнозу (6 місяців активної лихоманки, системних проявів або маркерів лабораторної активності) протягом 2 тижнів рекомендований прийом НПЗП, і лише при збереженні активності – призначення ГКС. У разі високого ступеня активності навіть за відсутності факторів несприятливого прогнозу хворим на системний ЮІА відразу призначаються ГКС.
Хворим на системний ЮІА у разі високого ступеня активності за наявності факторів несприятливого прогнозу відразу повинен бути призначений тоцилізумаб (за необхідності – доповнити цитостатичною або НПЗП-терапією). На жаль, виконання останньої рекомендації зовсім неможливе в умовах існуючої системи фінансування медичної галузі.
Нова редакція (2016) Клінічних настанов з лікування ЮІА підкреслює, що системні ГКС призначаються як швидкодіючий засіб хворим з високою активністю ЮІА, з органними проявами хвороби (увеїт, перикардит тощо), пацієнтам з поліартикулярним РФ+-ЮІА. Доза ГКС у разі тривалого використанні не повинна перевищувати 0,2 мг/кг маси тіла за преднізолоном.
Між іншим, сьогодні в світі дитячої ревматології відбувається певний ренесанс використання низьких доз ГКС на початку лікування ЮІА. Оновлені рекомендації ACR (American Colledge of Rheumatology, 2011) інформують про те, що якщо дітей з локалізованою формою хвороби можна лікувати тільки одними внутрішньосуглобовими ін’єкціями ГКС, то діти з активними системними проявами, загальною лікарською оцінкою 5 балів або вище або з кількістю суглобів з активним запаленням щонайменше 4-х, повинні лікуватися ГКС та/або анакінрою. Терапія тільки ГКС не повинна перевищувати 2 тижні, а за збереження симптоматики відразу призначається генно-інженерна біологічна терапія (ГІБТ).
Діти із синдромом гіперактивації макрофагів (САМ) можуть отримувати системні ГКС, анакінру й інгібітори кальциневрину.
Принципи раціональної пероральної глюкокортикоїдної терапії ЮІА
- початок лікування – за суворими показаннями (наявність системних проявів хвороби, високої активності з недостатнім ефектом НПЗП, зазначені вісцеральні ураження, небажані ефекти БХМТ);
- початкова доза ГКС обирається за стандартизованими показниками актив-ності;
- за потенційною можливістю тривалого застосування ГКС перевага має надаватися використанню метилпреднізолону, зважаючи на менш виразні його побічні ефекти;
- добова доза ГКС розподіляється індивідуально з урахуванням фізіологічних циркадних ритмів і піків клінічних проявів системної запальної відповіді у конкретного хворого;
- під час вибору препарату ГКС, режиму його прийому та визначенні необхідного обсягу супутньої терапії враховують наявність коморбідної патології: хронічних інфекцій, у тому числі тубінфікування, порушення толерантності до вуглеводів, гастроезофагеальної патології, артеріальної гіпертензії, порушень психічної діяльності тощо;
- під час переходу на підтримувальні дози ГКС можливе використання альтернуючої схеми терапії за умови її ефективності;
- бажано використання курсів з мінімальною тривалістю.
Існують певні особливості призначення ГКС і пацієнтам з іншими РЗ.
Хворим на гостру ревматичну лихоманку призначаються середні або високі дози ГКС, проте курс триває здебільшого 3-6 місяців.
Хворим на системну склеродермію ГКС призначаються у низьких і середніх дозах у разі розвитку міозитів, порушення ковтання, гострому ураженні легень, нирок і швидкого прогресування хвороби.
У дітей із системними васкулітамии ГКС призначаються завжди, при цьому в гострій стадії процесу перевага надається використанню вищих доз (від 2 мг/кг/добу). Винятком є геморагічний васкуліт, при якому пероральні ГКС призначаються лише за наявності гломерулонефриту з нефротичним синдромом або абдомінального кризу.
Системна глюкокортикостероїдна терапія СЧВ. ГКС є препаратами вибору у разі СЧВ, які призначаються у 100 % випадків. За власними даними протягом 5 років вдалося повністю відмінити ГКС лише 2 пацієнтам із СЧВ. Стартова доза зазвичай становить 1-2,5 мг/кг на добу за преднізолоном. Тривалість призначення стартової дози у хворих на СЧВ становить 1-3 місяці (до повного клінічного ефекту). Хворі вимагають повільнішого зниження дози препарату порівняно з пацієнтами з ЮІА або гострою ревматичною лихоманкою, проте частіше можливий перехід на інтермітуючу схему.
Глюкокортикостероїдна терапія ЮДМ. Як і у разі СЧВ, ГКС є засобами вибору у хворих на ЮДМ: при встановленні діагнозу вони призначаються усім хворим. Протягом 5 років пероральні ГКС вдається відмінити лише у 9 % пацієнтів з ЮДМ. Стартова доза при ЮДМ дорівнює середньо терапевтичному рівню – 1-2 мг/кг на добу за преднізолоном, причому перевага також надається метилпреднізолону, його неефективність відзначено лише у 6 % випадків. Особливістю ГКС-терапії у разі ЮДМ є триваліше призначення стартової дози – до стійкого ефекту, який досягається впродовж 1-4 і більше місяців. Зниження дози ГКС повинно бути дуже повільним (не більше 1/4 дози протягом 1 місяця). Через короткий проміжок часу від початку широкого застосування ГКС стало очевидним, що у разі тривалого системного використання середніх і високих доз цих препаратів неминуче розвиваються тяжкі токсичні реакції, які можуть повністю нівелювати позитивний ефект лікування.
Узагальнені небажані явища тривалої системної ГКС-терапії
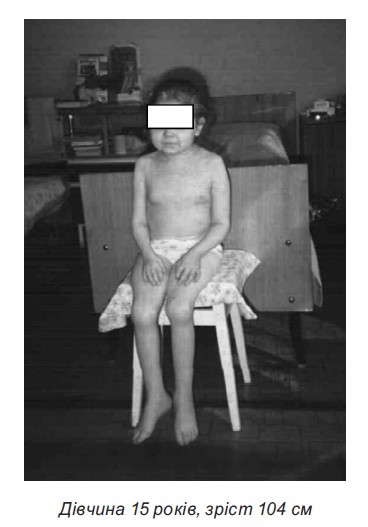
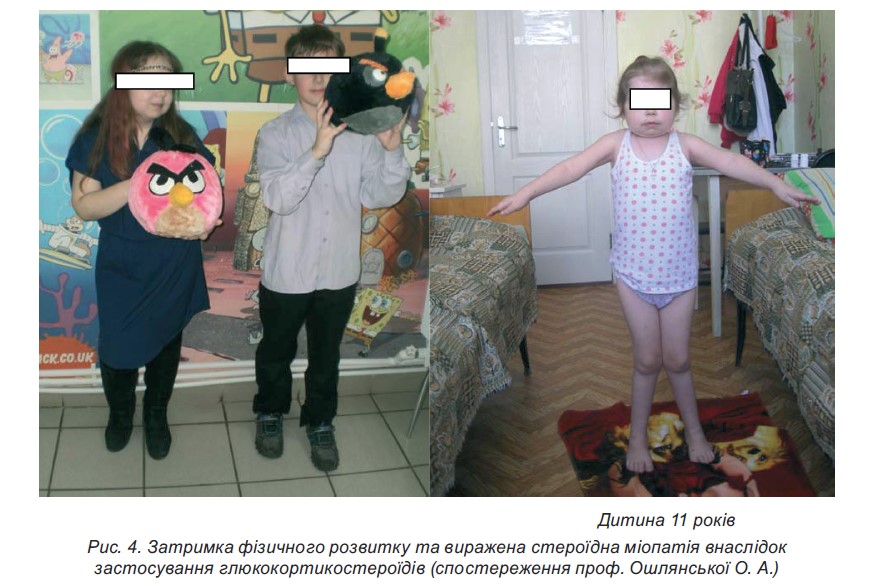
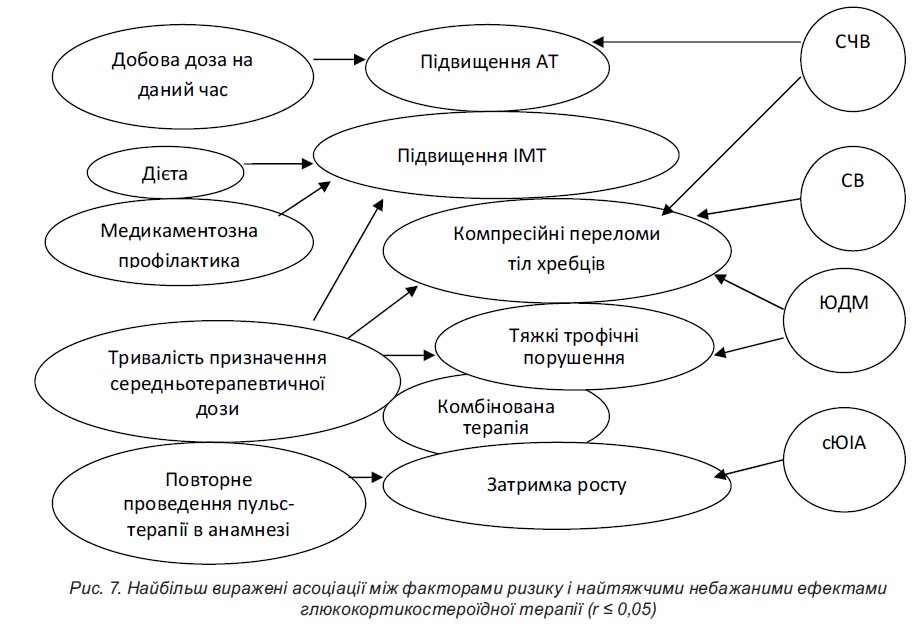
- Низькорослість. Для профілактики розвитку даного стану рекомендується призначати ГКС дітям віком до 5 років і дітям препубертатного віку за чіткими показаннями. Призначення ГКС може призвести до повної зупинки росту й обмеження пубертатного ростового «стрибка».
Діти із системним ЮІА (в меншому ступені з поліартикулярним ЮІА) мають більшу схильність до розвитку низькорослості та диспропорційного фізичного розвитку.
- Відставання у статевому розвитку. Рекомендуються регулярні консультації відповідних спеціалістів.
- Артеріальна гіпертензія (ізольоване підвищення систолічного артеріального тиску (АТ) або підвищення систолічного і діастолічного АТ). Доцільне моніторування АТ вже з початку призначення тривалого курсу високих доз ГКС. У разі гіпертензії та ураження нирок антигіпертензивні препарати можуть призначатися профілактично.
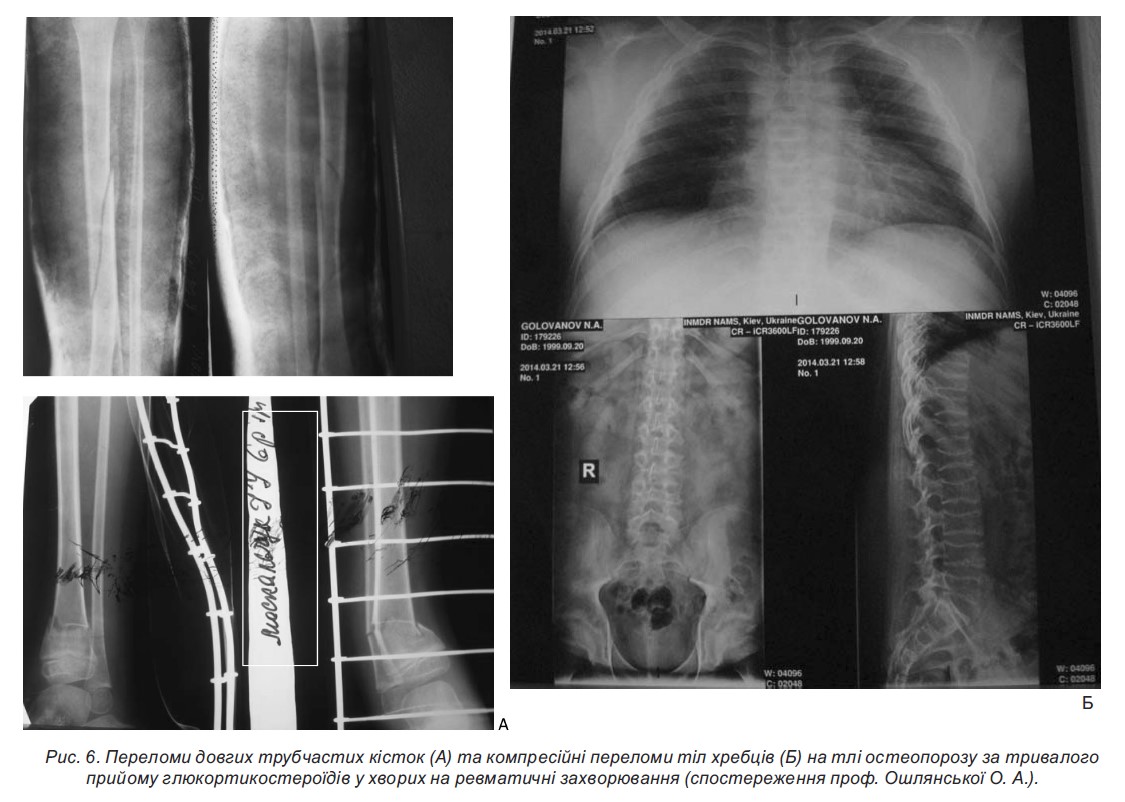
- Стероїдний остеопороз розвивається у всіх хворих. Нашвидка втрата кісткової маси на тлі лікування ГКС відбувається протягом перших 6-12 місяців терапії. Найвищий ступінь остеопорозу спостерігається у грудному і поперековому відділах хребта у вигляді зниження висоти тіл хребців і компресійних переломів, а також симптомів стискання корінців спинного мозку і вираженого больового синдрому у хребті, п’ятах, кульшових суглобах. Доцільною є регулярна (1 раз на рік) денситометрія.
- Ожиріння, яке має характерні риси: місяцеподібне лице, відкладення жиру на шиї, грудях, животі, стероїдний ≪горб≫, атрофія м’язів рук і ніг.
- Виразкові процеси у верхніх відділах травного каналу у дітей спостерігаються зрідка. Перед призначенням ГКС доцільним є попереднє ендоскопічне обстеження хворого, а потім у процесі лікування ГКС – регулярний клінічний огляд, виявлення типових скарг, за їх наявності –рекомендовано проводити ендоскопічний контроль травного каналу. Прийом ГКС не проводиться натщесерце. З профілактичною метою при обтяженого анамнезу можливо призначати обволікальні засоби, антациди, інгібітори протонної помпи.
- Стероїдна міопатія у випадках виразного підтвердженого міопатичного синдрому. Можуть призначатися трофічні засоби. Профілактики не потребує.
- Задньокапсульна катаракта потребує регулярного огляду окуліста.
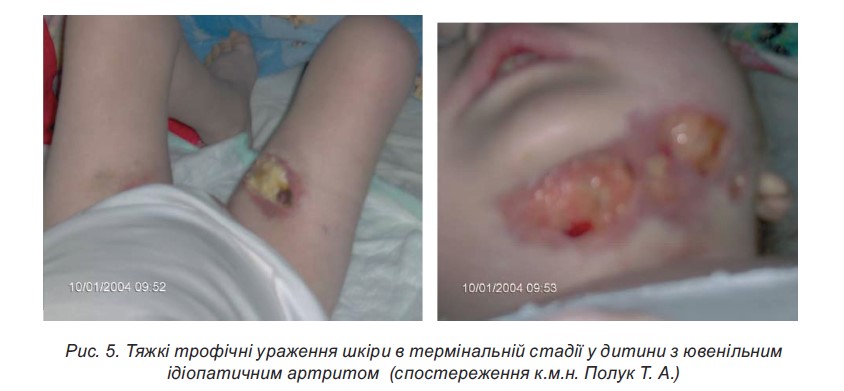
- Шкірні зміни (гіпертрихоз, гнійна інфекція шкіри, стрії, травматизація шкіри, грубі рубці, погіршення загоєння ран, стероїдні вугри на обличчі та тулубі) – у разі вираженості процесу доцільна консультація дерматолога.
- Розвиток гормонорезистентності: безперервні рецидиви захворювання під час лікування підтримувальними дозами ГКС.
- Розвиток гормонозалежності: загострення хвороби на тлі зниження дози або скасування ГКС.
- Синдром відміни.
У спостережених нами хворих також відзначені певні небажані ефекти ГКС (табл. 6).
Вважається, що надлишок ГКС підсилює попередні порушення діяльності ЦНС, проте патофізіологічний механізм цих проявів дотепер повністю не з’ясований. Виникнення змін психіки у хворої на СЧВ потребувало проведення диференціальної діагностики зі специфічним вовчаковим цереброваскулітом, вирішальне значення при цьому мало зникнення симптоматики під час швидкого зниження дози ГКС до підтримувальної. Ми спостерігали також розвиток поліурії, полідипсії і ніктурії за відсутності глюкозурії після проведення курсу пульстерапії ГКС у 2-ох хворих на СЧВ та одного пацієнта з геморагічним васкулітом. Підвищення діурезу до 3-5 л на добу може бути зумовлено антагоністичною дією ГКС щодо ефектів антидіуретичного гормону на ниркові канальці, що викликає посилення інактивації антидіуретичного гормону і збільшення фільтрації.
У зв’язку з вираженою імуносупресивною дією ГКС-терапія може ускладнюватися тяжким перебігом бактеріальних, вірусних, грибкових і паразитарних інфекцій, до яких особливо схильні хворі з імунодефіцитними станами. На жаль, у таких ситуаціях навіть застосування довенного імуноглобуліну, антибактеріальних і противірусних препаратів не завжди профілактує розвиток фатального кінця. У нашій практиці відзначався випадок летального результату внаслідок тяжкого перебігу вітряної віспи у хворої з вузликовим поліартеріїтом, яка отримувала середню лікувальну дозу ГКС. У літературі є повідомлення про успішне використання з профілактичною метою у дітей, які тривалий час отримують ГКС-терапію, семиденного курсу ацикловіру у віковому дозуванні, починаючи з 7-9-го дня від контакту з хворим на вітряну віспу
Ще одним серйозним ускладненням тривалої ГКС-терапії є розвиток компресійних переломів хребта. ГКС, як відомо, не тільки безпосередньо знижують білково-синтетичну функцію остеобластів, а й пригнічують перетворення преостеобластів в остеобласти, блокують фізіологічну дію вітаміну D в організмі на рівні клітинних рецепторів унаслідок подібності біохімічної будови. Результати наших досліджень показали, що при використання як лікувальних, так і підтримувальних доз ГКС у всіх хворих спостерігалися прогресуючі відхилення в кальцієвому гомеостазі і D-вітамінної забезпеченості організму, найбільш виражені у разі ЮІА що пов’язано з односпрямованим негативним впливом на процеси остеогенезу цитокінового дисбалансу, що властиве цій хворобі. У більшості випадків остеопенічний синдром тривалий час перебігає безсимптомно, больовий синдром має незапальний характер і посилюється у разі тривалого статичного навантаження. Проте у 3 хворих із системним ЮІА, 4 пацієнтів з ЮДМ і 2-х дітей з недиференційованим системним захворюванням сполучної тканини (СЗСТ) під час використання пульс-терапії або високих початкових лікувальних доз ГКС відбулися компресійні переломи хребців.
Ще одним небезпечним, але, на щастя, рідкісним ускладненням є розвиток асептичного некрозу голівок трубчастихкісток, який ми спостерігали у 2-х хворих на ЮІА, які тривалий час отримували преднізолон. Виникнення під час лікування ГКС артралгій, особливо в плечовому, кульшовому і колінному суглобах, повинно насторожувати лікаря щодо розвитку цього ускладнення.
Запобігти розвитку ускладнень від системного застосування ГКС дозволяє проведення адекватного клініколабораторного моніторингу зі своєчасною корекцією терапії.

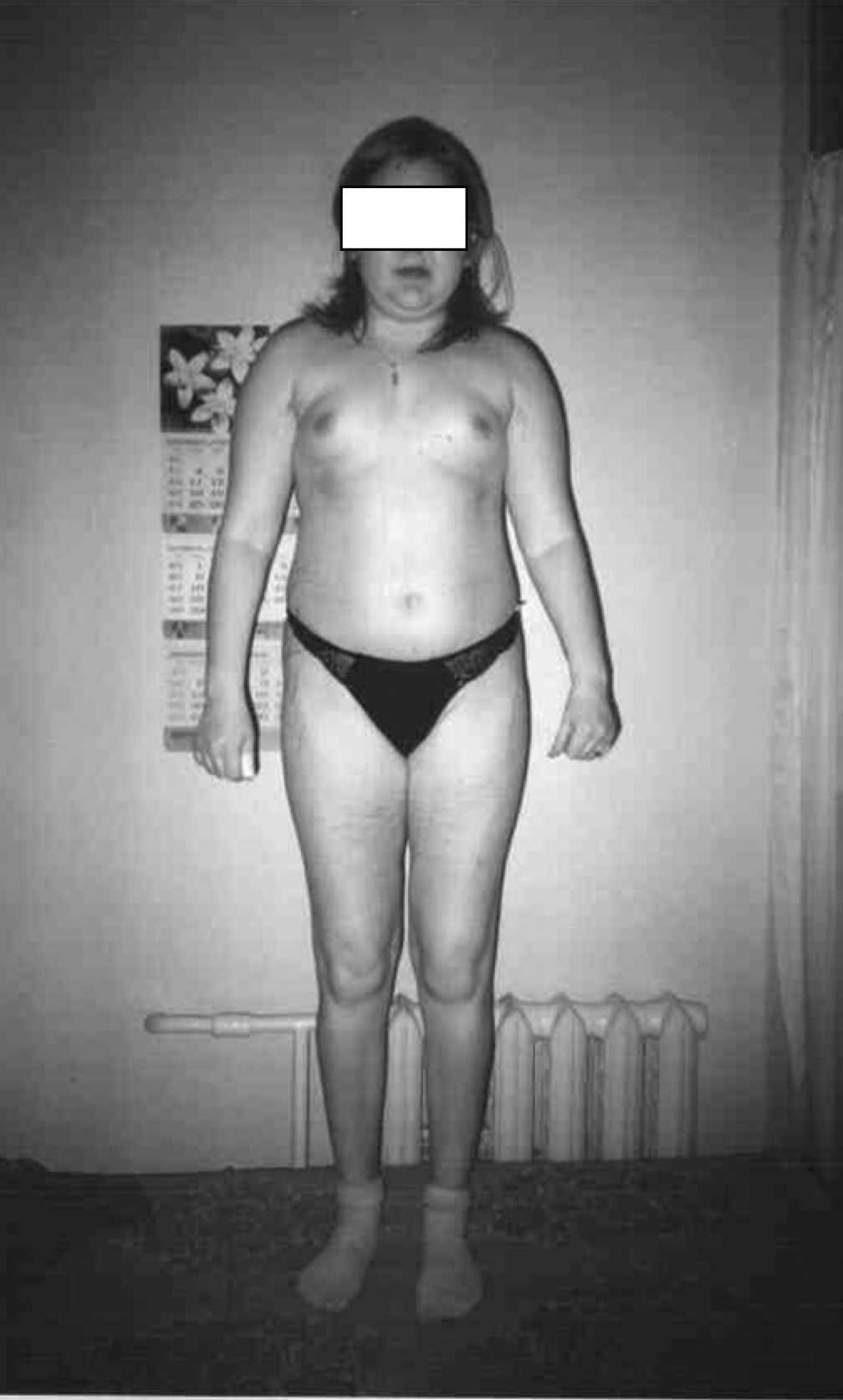
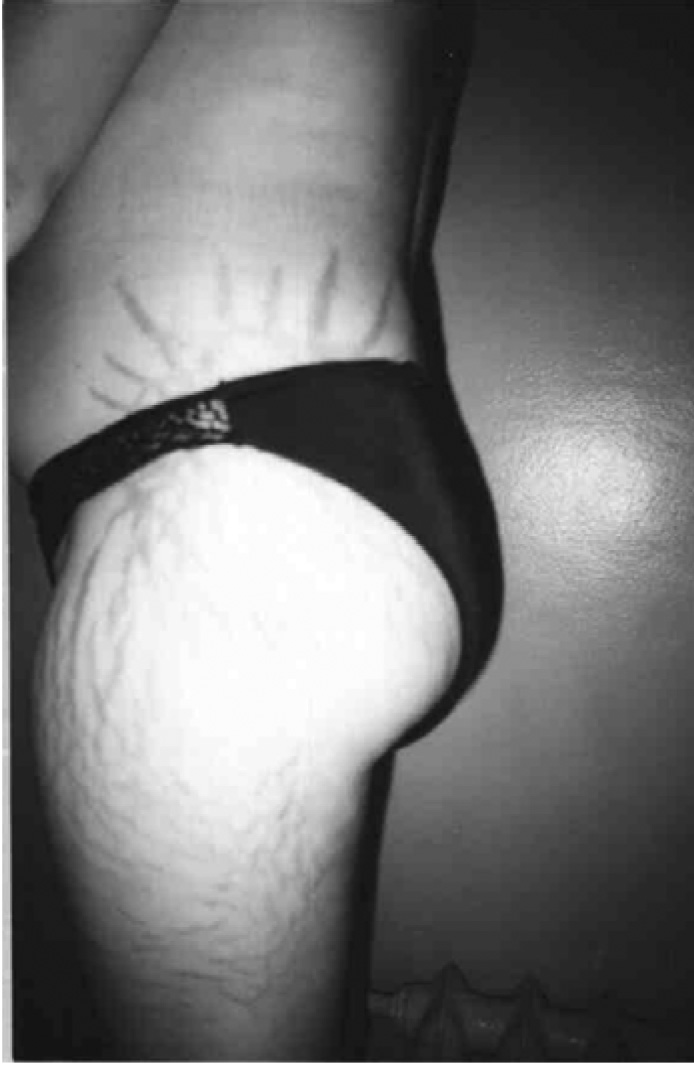
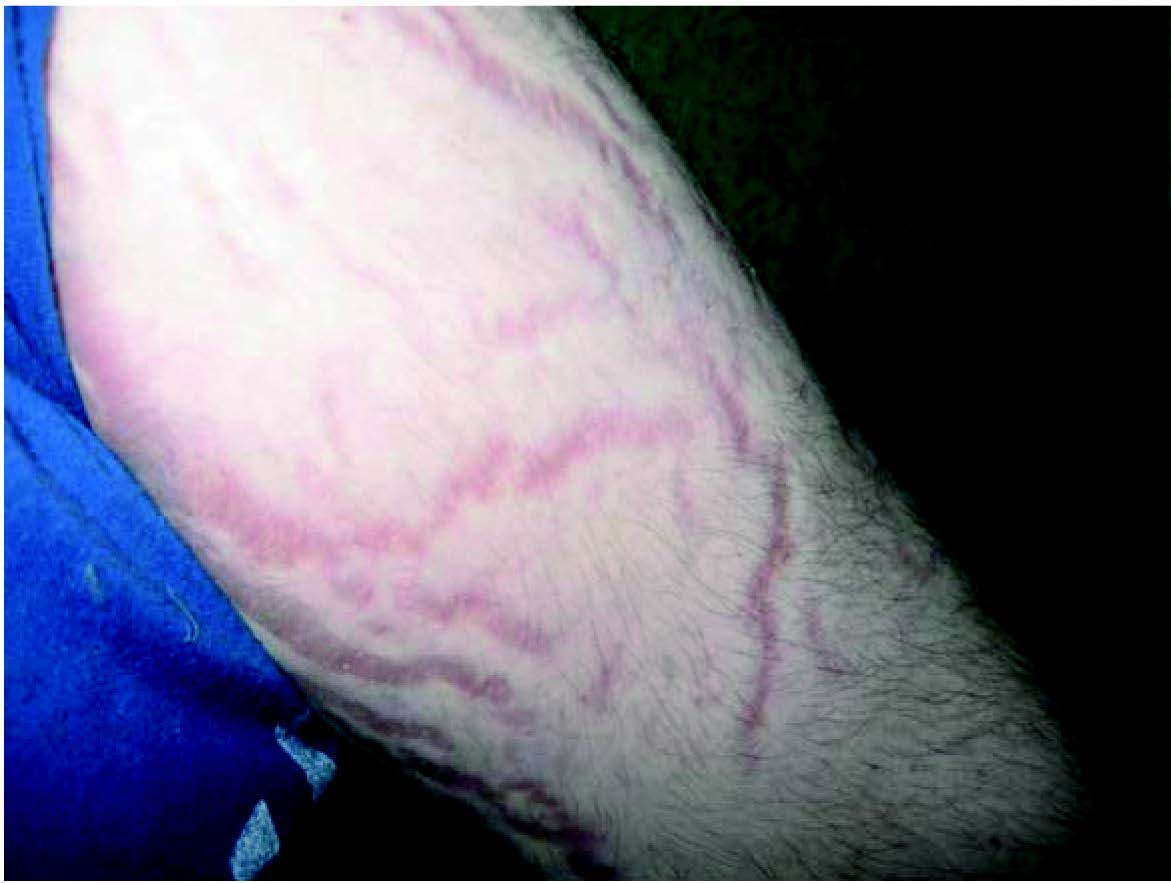
Рис. 3. Прояви синдрому екзогенного гіперкортицизму: типове місяцеподібне лице, перерозподіл жирової тканини, гірсутизм, стрії (спостереження проф. Ошлянської О. А.)

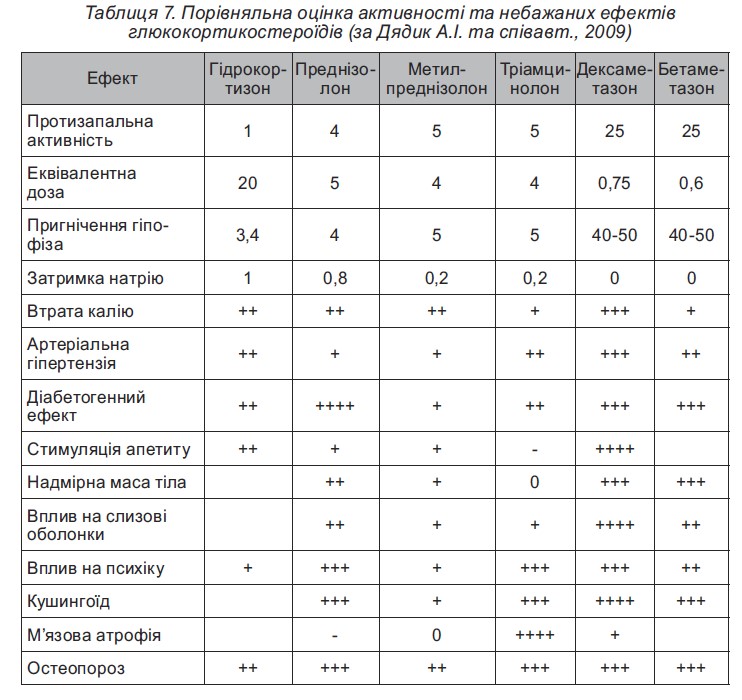
Вираженість небажаних ефектів у разі застосування різних ГКС може відрізнятися (табл.7).
Отже, найкращими серед синтетичних ГКС за стійкістю і виразністю лікувального ефекту і сприйманням є преднізолон і метилпреднізолон. Перевагою триамцинолону (полькортолону), на перший погляд, є менша затримка в організмі пацієнта натрію і води, тому він іноді викликає навіть схуднення хворих, але поряд з цим і слабкість, м’язову атрофію, частіше спостерігаються гастродуоденальні ерозії та виразки і вазомоторний синдром з відчуттям припливу крові до голови. Тому для тривалого застосування в педіатричній практиці цей препарат непридатний. Дексаметазон (дексазон) може призводити до значної затримки рідини в організмі з розвитком недостатності кровообігу. Кортизон у даний час практично не застосовується у зв’язку з меншою ефективністю і гіршим сприйманням.
Переваги метилпреднізолону: менша кількість побічних ефектів за збереження протизапального ефекту. Особливі переваги має препарат метипреднізолону ≪Медрол≫: наявність різних форм випуску препарату, єдиний препарат, який застосовується для пульс-терапії у дітей в Україні, наявність різних дозувань у таблетованих препаратах, що підвищує комплаєнсність пацієнтів.
У ДУ ≪ІПАГ ім. акад. О.М. Лук’янової НАМНУ≫ проведене дослідження щодо визначення частоти та особливостей уражень травного каналу у дітей, які отримували ГКС-терапію з приводу РЗ.
За даними Л. І. Омельченко Л.І. та І. В. Дудки (2009), серед 206 проаналізованих випадків використання ГКС у хворих на РЗ, з яких 54 – отримували ще НПЗП, а 187 – БХМТ, в 11,16 % дітей була наявна попередня шлунково-кишкова патологія. Упродовж проведення курсу ГКС нові скарги з боку травного каналу з′явилися у 26,7 % дітей. При проведенні фіброгастродудоденоскопії у 82,4 % виявлено ознаки прояви катаральної гастропатії, лише у 2,9 % випадків відзначено ерозивне ураження слизових оболонок шлунка, у 3,8 % – поширене ураження, причому всі діти з ерозивним і поширеним ураженням отримували водночас ГКС+НПЗП+БХМТ.
Помилки застосування ГКС:
- використання пульс-терапії без обґрунтованих показань (у разі ЮІА – 36,3 %);
- невмотивоване подовження тривалості курсів (1,4 %);
- швидке зниження дози або спроба відміни (3,9 %) – призначення ГКС у середньотерапевтичних і високих дозах протягом 2-4 місяців; підтримувальна доза менше 6 місяців; не враховувалася вихідна добова доза під час вибору схеми зниження);
- використання монотерапії (5,9 %);
- підвищення дози без спроби корекції режиму прийому (1,2 %);
- неадекватний моніторинг (14,17 %).
Моніторинг у хворих, які отримують ГКС-терапію, повинен включати:
- контроль маси тіла, корекцію дієти;
- контроль АТ;
- контроль рівня глюкози в крові;
- контроль електролітного складу плазми, корекція за необхідності;
- контроль функціонального стану травного каналу, профілактика і лікування уражень;
- контроль проявів та профілактика остеопорозу;
- профілактика інфекційних ускладнень.
Раціоналізація системної глюкокортикоїдної терапії РЗ у дітей передбачає:
- початок за суворими показаннями;
- стартова доза повинна залежати від активності хвороби;
- раціональний та індивідуалізований розподіл добової дози;
- ширше використання альтернуючих схем;
- урахування наявності коморбідної патології та імунного статусу (гастропротекція, лікування остеопорозу тощо);
- мінімально ефективна доза і мінімально можлива тривалість курсу.
Незважаючи на відстуність доказової бази ефективності ГКС у разі РЗ згідно сучасних вимог, їхня безумовна клінічна ефективність підтверджена півстоліттям успішного використання.
Їх призначення подарувало життя багатьом людям, які хворіють на тяжкі автоімунні захворювання. Відкриття надзвичайно високої їх ефективності при РА в свій час стало проривом в лікуванні цієї хвороби і послужило підставою для присудження в 1950 році Нобелівської премії з медицини американським вченим Хенчу, Кендалу і Рейхстену.
Проте, незважаючи на багаторічний досвід застосування ГКС-терапії при РЗ у дітей, вибір препарату й індивідуальної для кожного хворого схеми лікування представляє певні труднощі. Тому остаточне рішення про її доцільність і режим проведення, особливо, у вигляді пульс-терапії, з метою отримати максимальний терапевтичний ефект і запобігти розвитку ускладнень, має прийматися фахівцями клінік ревматологічного профілю, що мають відповідну кваліфікацію, що грунтується на достатньому клінічному досвіді у застосуванні засобів цієї групи.
Вкрай необхідно виключити використання в педіатричній практиці при відсутності показань (з жарознижувальною метою), конкретизувати показання для початку ГКС-терапії і доцільність проводити пульс-терапії, схем моніторування і методи профілактики небажаних подій у Національних протоколах лікування РЗ, впровадження карт отримання ГКС.




 Дорогі колеги! Ми звикли, що один день у році, День медичного працівника, вся країна з вдячністю говорить про медиків. Лише один день! Але цей рік змінив все…
Дорогі колеги! Ми звикли, що один день у році, День медичного працівника, вся країна з вдячністю говорить про медиків. Лише один день! Але цей рік змінив все…
Останні коментарі