Зайков С.В.
Національний університет охорони здоров’я України ім. П.Л. Шупика
АЛЕРГІЯ У ДИТИНИ 27/28 2021
Основними напрямами лікування пацієнтів дитячого та дорослого віку з алергічними захворюваннями (АЗ) відповідно до рекомендацій ВООЗ традиційно залишаються: освітні програми для пацієнтів, елімінаційна терапія, можливостям якої буде присвячена дана публікація, фармакотерапія та алергенспецифічна імунотерапія. Елімінацією в контексті АЗ називається видалення з навколишнього середовища пацієнта різних факторів, перш за все причинно-значущих алергенів, здатних спричинювати загострення захворювання і збільшувати ризик погіршення його клінічних проявів. У зв’язку з цим елімінація алергенів належить до надзвичайно важливих патогенетичних методів лікування та профілактики АЗ, особливо у разі гіперчутливості до інгаляційних, харчових, медикаментозних, інсектних, латексних алергенів і алергенів домашніх тварин [1, 2].
На даний час до перспективних елімінаційних заходів у разі АЗ органів дихання, а також ринітів і синуситів інфекційної природи все ширше використовують зволожувальні та гігієнічні процедури у формі носового душу, в основі якого лежить промивання, зрошення порожнини носа сольовими розчинами з лікувальною та/або профілактичною метою. Носовий душ (син. промивання порожнини носа, носовий лаваж, назальна іригація) є однією з найбільш древніх терапевтичних процедур, яка була описана ще в давньоіндійських ведах. На сьогодні в низці досліджень з високим рівнем доказовості [10-14, 25, 26, 30, 31] показана ефективність і безпечність назальної іригації, оскільки вона сприяє:
• механічному очищенню слизової оболонки носа від в’язкого, густого слизу, кірок;
• усуненню застійних явищ у порожнині носа;
• посиленню мукоциліарної активності та кращому очищенню слизової оболонки носа від алергенів, інфекційних агентів, хімічних речовин, медіаторів запалення, метаболітів оксиду азоту тощо;
• зменшенню тривалості контакту патогенних частинок з поверхнею слизової оболонки порожнини носа і обмеженню запалення;
• зменшенню сухості слизової оболонки порожнини носа, її додатковому зволоженню;
• посиленню репарації клітин слизової оболонки носа;
• поліпшенню носового дихання;
• усуненню кашлю, зумовленого стіканням слизу по задній стінці глотки;
• забезпеченню підготовки слизової оболонки порожнини носа до кращого сприйняття лікарських засобів для інтраназального застосування (глюкокортикостероїди (ГКС) й антигістамінні препарати (АГП));
• зменшенню потреби в цих та інших медикаментозних препаратах для інтраназального застосування.
До суттєвих переваг методу назальної іригації відносять:
• безпечність;
• добре сприйняття пацієнтами, в тому числі дітьми, вагітними та жінками, що годують груддю, особами похилого віку;
• можливість тривалого, практично довічного використання у разі хронічних захворювань (у тому числі алергічного риніту) без істотних побічних ефектів;
• доступність для пацієнтів [25, 31].
Все це посприяло тому, що метод назальної іригації з рівнем доказовості А (рівень 1a: 1 дослідження; рівень 1б: 11 досліджень) був включений в низку міжнародних рекомендацій як ефективний і безпечний метод комплексного лікування пацієнтів з алергічним ринітом (АР) і неалергічними ринітами/риносинуситами [4, 9, 10, 33]. Назальні іригації сольовими розчинами часто використовують для лікування пацієнтів з АР. Однак слід зауважити, що термін «назальний сольовий розчин» охоплює широкий спектр терапевтичних схем його застосування. До них можна віднести використання гіпертонічного фізіологічного розчину, ізотонічного/нормального фізіологічного розчину, морської води, буферних або небуферних розчинів і різних їх об’ємів, що варіюють від 300 мкл до 500 мл на введення. Режими застосування методу назальної іригації також варіюють у різних дослідженнях, що інколи викликає додаткові запитання.
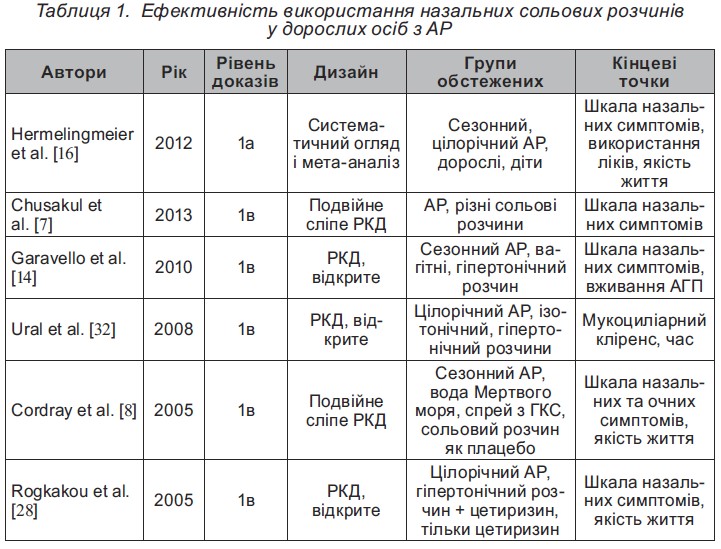
Важливо, що у міжнародному консенсусі IСAR2018 [33] представлені результати багатоцентрових досліджень у дітей і дорослих із застосуванням водносольових розчинів. Був проведений метааналіз результатів 5 рандомізованих контрольованих досліджень (РКД) та 1 систематичний огляд [16], що охоплював усі вікові групи пацієнтів. Результати вказаних досліджень, які наведені в таблицях 1 та 2, достатньо переконливо довели, що за використання пацієнтами ізотонічного фізіологічного розчину в разі персистуючого АР більшою мірою поліпшуються реологічні властивості назального слизу і, відповідно, покращується мукоциліарний кліренс.
Chusakul S. et al. [7] також визначили, що буферний ізотонічний фізіологічний розчин помірної лужності найкраще знижує показники назальних симптомів, тому більшість пацієнтів віддають перевагу саме йому. Але Cordray S. Et al. [8] встановили, що сольовий спрей на основі води Мертвого моря суттєво зменшує показники назальних симптомів за візуально-аналоговою шкалою та поліпшує якість життя пацієнтів з АР порівняно з ізотонічним фізіологічним розчином для назальної іригації. Також Cordray S. et al. [8] припустили, що магній у фізіологічному розчині з води Мертвого моря може мати додаткові протизапальні властивості, в результаті чого поліпшуються результати лікування пацієнтів з АР.
За даними інших дослідників, гіпертонічні сольові розчини більш суттєво покращують мукоциліарний кліренс порівняно з ізотонічними, що, вірогідно, пов’язано з вираженішими позитивними змінами реологічних властивостей слизу [17, 23, 32]. Переваги гіпертонічних розчинів обумовлені механізмом їх дії: завдяки осмотичному ефекту вони здатні полегшити носове дихання, тоді як ізотонічні сольові розчини лише очищують і зволожують слизову оболонку. Протинабрякова і муколітична дії гіпертонічного розчину реалізуються за рахунок транспорту тканинної рідини в носовий секрет за осмотичним градієнтом. При цьому слід ураховувати наявність прямої бактерицидної дії гіпертонічного розчину.
Також однією з переваг гіперосмолярних сольових розчинів є зниження назальної обструкції за рахунок вираженого протинабрякового ефекту. Однак є дані про можливий негативний циліотоксичний ефект гіпертонічних розчинів, причому його ступінь корелює з концентрацією розчину. Так, наприклад, за концентрації гіпертонічного розчину хлориду натрію, яка дорівнює 3-7%, виникають оборотні, а у разі 14% – необоротні циліостатичні ефекти, хоча такі високі концентрації розчину не рекомендуються для використання в медичній практиці [3, 22].
Цікаві дані про вплив на циліарну активність і мукоциліарний кліренс різних препаратів для інтраназального застосування наводять Jiao J., Zhang L. (2019). У своєму огляді [18] автори подають результати впливу різних класів інтраназальних препаратів, у тому числі інтраназальних ГКС, АГП, деконгестантів, антимікробних і противірусних препаратів, а також різних допоміжних речовин і розчинів для зрошення носа на мукоциліарний кліренс носа та частоту рухів циліарних війок. Наявні дані свідчать про те, що деякі інтраназальні препарати, як правило, утрудняють циліарну функцію носа та мукоциліарний кліренс. Тому велике значення має оцінка впливу інтраназальних препаратів і добавок на мукоциліарну функцію, перш ніж вони будуть рекомендовані для лікування різних захворювань носа та приносових пазух. Важливе значення має вивчення можливостей використання іригацій сольовими розчинами в дитячій практиці.
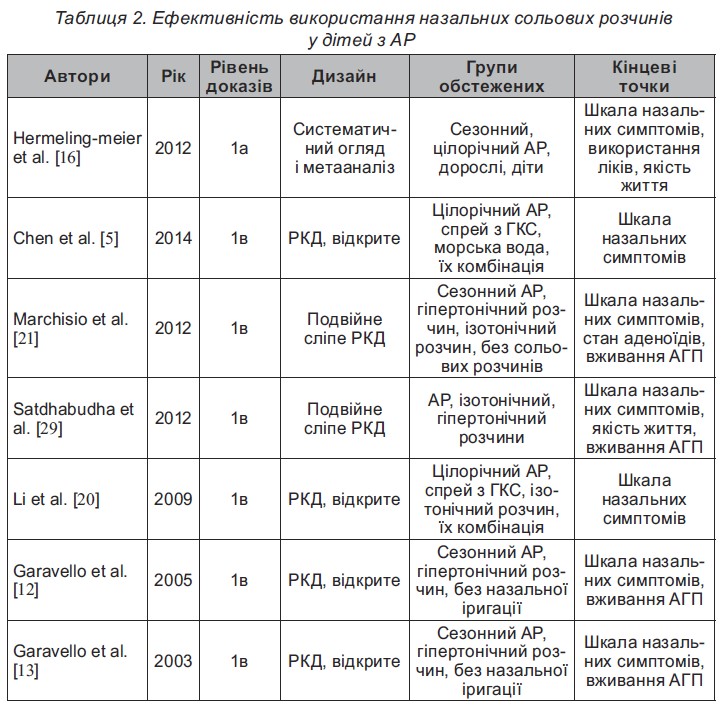
Результати РКД, які проводили за участю дітей з цілорічним або сезонним АР, виявили поліпшення назальних симптомів та/або якості життя дітей за використання у схемі лікування сольових розчинів для інтраназального застосування.
Обидва дослідження Garavello W. et al. [12, 13] показали значне поліпшення назальної симптоматики в групі дітей, яким призначали гіпертонічні сольові зрошення порожнини носа тричі на день, порівняно з групою дітей, які не користувалися назальними іригаціями. Marchisio P. et al. [21, 29], Satdhabudha A., Poacha nukoon O. [29] встановили, що гіпертонічні сольові зрошення порожнини носа ведуть до більш значного покращання показників назальних симптомів у дітей порівняно з дітьми, які використовували ізотонічні фізіо логічні розчини. Крім того, Li et al. [20] та Chen et al. [5] виявили синергічний ефект за одночасного використання назального сольового спрея і назального ГКС у порівнянні з їхнім використанням окремо. Крім того, слід очікувати на позитивний вплив назальної іригації на перебіг бронхіальної астми, яка має місце у значної частини пацієнтів з АР, хоча дослідження з цього напряму слід продовжити.
Однак дискусія навколо ефективності використання сольових розчинів залежно від показника їх рН продовжується донині. Систематичний огляд Hermelingmeier K. E. et al. [16] включив 10 досліджень, з яких 7 були РКД, які оцінювали результати лікування дорослих і дітей з АР.
Цей огляд показав, що результати майже всіх досліджень продемонстрували покращання назальних симптомів з 3,1 до 70,5% у разі додавання до лікування назального фізіологічного розчину. Крім того, в результатах РКД пацієнтами відзначено зменшення споживання лікарських препаратів з 24,2 до 100%, а також поліпшення якості життя з 29,8 до 37,5%.
В даному огляді також було зроблено припущення, що ізотонічний фізіологічний розчин для інтраназального використання ефективніший, ніж гіпертонічний фізіологічний розчин, а також відзначено, що назальний фізіологічний розчин є так само ефективним, як і інші фармакологічні методи лікування осіб з сезонним і цілорічним АР.
Результати іншого метааналізу продемонстрували певні переваги гіпертонічного сольового розчину для назальної іригації перед ізотонічним щодо впливу на клінічну симптоматику в пацієнтів, але не на показники якості життя, які покращилися в обох групах пацієнтів однаково [19]. Ще в одному огляді [6] було продемонстровано, що застосування ізотонічних і гіпертонічних сольових розчинів для полегшення закладеності носа у немовлят і дітей є широко поширеною процедурою, яка є безпечною і цінною терапевтичною підтримкою і може зменшувати використання медикаментів (АГП, деконгестантів, антибіотиків, ГКС) під час лікування АР та неалергічного риніту.
Цікавий огляд щодо ефективності та безпечності використання назальних сольових розчинів у лікуванні пацієнтів з АР був зроблений рецензентами Кохранівської співпраці Head K. et al. [15]. Автори проаналізували результати 14 РКД (747 учасників). У дослідженнях взяли участь діти (7 досліджень, 499 учасників) і дорослі (7 досліджень, 248 учасників).
До огляду ввійшли дослідження, в яких порівнювали ефективність і безпечність назальних іригацій (гіпертонічний або ізотонічний сольовий розчин) з плацебо та використанням сольових розчинів разом з фармакотерапією інтраназальнимиГКС або пероральними АГП. При цьому оцінювали вираженість назальних симптомів за візуально-аналоговою шкалою, показники якості життя пацієнтів, можливі несприятливі наслідки у вигляді місцевого подразнення чи дискомфорту під час використання препаратів і показники ендоскопії порожнини носа. Загалом, незважаючи на певну неоднорідність методології вказаних РКД, автори відмітили достатню ефективність (поліпшення показників назальних симптомів, якості життя, ендоскопічної картини носа) і безпечність назальних іригацій у пацієнтів з АР як дорослого, так і дитячого віку, а також висловили припущення, що зрошення порожнини носа сольовими розчинами могло б забезпечити дешеву, безпечну та прийнятну альтернативу інтраназальним ГКС та АГП. Отже, є вагомі докази, що підтверджують ефективність використання назального фізіологічного розчину як допоміжного методу лікування пацієнтів з сезонним і цілорічним АР. Показано, що в дорослих буферизований ізотонічний спрей може забезпечити максимальну користь. Однак у дітей може бути ефективнішим гіпертонічний розчин. Результати деяких досліджень відзначили меншу частоту виникнення подразнення слизової оболонки носа в разі використання ізотонічних розчинів на відміну від гіпертонічних. Гіпотонічний фізіологічний розчин не вивчався як метод лікування АР. Додавання розчину легкої лужності (рН 7,2-7,4) може ще більше покращити сприйняття інтраназальних іригацій [7].
Хоча показано, що назальний фізіологічний розчин сприяє покращанню назальних симптомів та якості життя пацієнтів з АР, вказаний метод часто застосовують як доповнення до інших методів терапії, у тому числі топічних ГКС, АГП для місцевого або перорального застосування. Як у дорослих, так і у дітей назальний сольовий розчин виявляє додатковий клінічний ефект у разі поєднання з іншими базисними методами лікування АР. Крім того, сольовий розчин для носа має відносно низьку вартість і чудовий профіль безпеки.
Звичайно, що, характеризуючи будь-який метод лікування, слід звертати увагу не лише на його ефективність, але й безпечність. Небажані побічні ефекти у разі використання іригацій сольовими розчинами вкрай рідкісні, але під час їх застосування можливе виникнення місцевого подразнення, кровотечі з носа, болю голови, печіння слизової оболонки носа та забруднення доставкового пристрою з сольовим розчином [24]. З урахуванням всього вищенаведеного методу назальної іригації ізотонічними та гіпертонічними розчинами присвоєні найвищі рівні доказовості (IA) й обґрунтованості рекомендацій (А).
Відомо, що закладеність носа внаслідок назальної обструкції є одним з найважчих і небезпечних симптомів АР.
В його усуненні високу ефективність продемонстрували назальні деконгестанти, а також засоби, що очищують порожнину носа від патологічного вмісту і відновлюють роботу миготливого епітелію (буферні, ізотонічні й особливо гіпертонічні розчини). У клінічній практиці в разі вираженої закладеності носа пацієнтами дорослого та дитячого віку часто, і нерідко зовсім безконтрольно, застосовуються назальні деконгестанти (оксиметазолін, ксилометазолін, нафазолін), які досить швидко усувають цей виснажливий симптом. Однак середня тривалість лікування такими препаратами не має перевищувати 3-5 днів, оскільки тривале (>10 днів) використання місцевих вазоконстрикторів може призводити до тахіфілаксії, вираженого набряку слизової оболонкиноса та розвитку медикаментозного риніту, а також до таких системних побічних ефектів, як артеріальна гіпертензія, серцебиття, біль голови, неспокій, сухість і подразнення слизової оболонки, нудота, ризик яких особливо високий у разі прийому цих препаратів усередину.
У дітей застосування системних деконгестантів взагалі не рекомендується, а місцеві деконгестанти використовують у вдвічі меншій концентрації порівняно з дорослими пацієнтами. Крім того, відомо, що назальні деконгестанти певною мірою можуть спричинювати класоспецифічні побічні ефекти у вигляді відчуття печіння, сухості слизової оболонки, чхання, реактивної гіперемії, пригнічення активності війок миготливого епітелію, що суттєво обмежує їх застосування у разі АР і ринітів іншої етіології.
Зокрема, найбільший циліотоксичний ефект виявлений у похідних нафазоліну, в зв’язку з чим в європейських країнах він вже не використовується. Крім того, до складу більшості деконгестантів для інтраназального застосування входять консерванти (наприклад, бензалконію хлорид), які ще більше підвищують ризик розвитку сухості, гіперемії слизової оболонки й ослаблення функції миготливого пітелію. Консерванти не лише знижують рухливість війок миготливого епітелію, а й перешкоджають процесу самоочищення порожнини носа, що може мати негативні наслідки для пацієнтів.
У подібній ситуації вдалою, з точки зору ефективності та безпеки, альтернативою назальним деконгестантам є гіпертонічні сольові розчини для назальної іригації, ефективність і безпека яких доведена низкою досліджень з високим рівнем доказовості [11, 12, 26, 27, 31].
Механізм позитивного терапевтичного ефекту гіпертонічних сольових розчинів у разі АР пов’язаний з тим, що завдяки осмотичному ефекту рідина з набряклої (в результаті хронічного запалення) слизової оболонки переходить у порожнину носа, що веде до зменшення набряку, розрідження назального секрету, поліпшення його плинності, дренування пазух, поліпшення носового дихання. Такий результат від застосування гіпертонічних сольових розчинів досягається за рахунок їх подвійної дії:
• завдяки осмотичному ефекту гіпертонічної морської води зменшується набряк слизової оболонки носа, розріджується назальний секрет і поліпшується його виведення;
• промивання носа забезпечує очищення слизової оболонки носа від алергенів і патогенів, підвищує тонус капілярів, зумовлюючи протизапальну і протинабрякову дію препарату.
Таким чином, у лікуванні, профілактиці розвитку і загострень АР особливе місце посідають елімінаційні заходи, в тому числі й за допомогою назальних іригацій сольовими розчинами. Їх більше не слід вважати лише допоміжними методами лікування пацієнтів з АР, оскільки вони останніми роками в низці РКД продемонстрували ефективність і безпечність.
На деякі питання щодо їх використання поки немає остаточних відповідей, але вони з’являться в результаті проведення подальших клінічних досліджень. Методи проведення назальних іригацій сольовими розчинами повинні бути стандартизовані, як і пристрої для їх виконання, схеми та тривалість відповідного лікування. Це особливо важливо для використання даного методу в педіатричній практиці. Однак існуюча доказова база дає змогу ширше користуватися елімінаційно-іригаційним методом для лікування пацієнтів не лише з АР, а й багатьма формами неалергічних ринтів.
Список використаних літературних джерел у редакції







 Дорогі колеги! Ми звикли, що один день у році, День медичного працівника, вся країна з вдячністю говорить про медиків. Лише один день! Але цей рік змінив все…
Дорогі колеги! Ми звикли, що один день у році, День медичного працівника, вся країна з вдячністю говорить про медиків. Лише один день! Але цей рік змінив все…


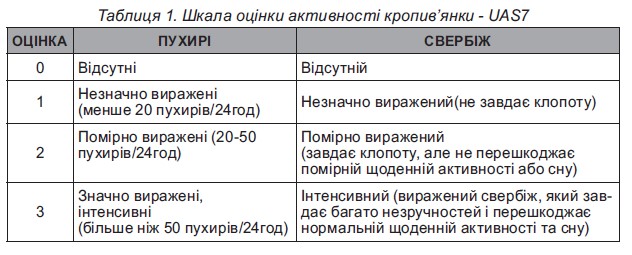
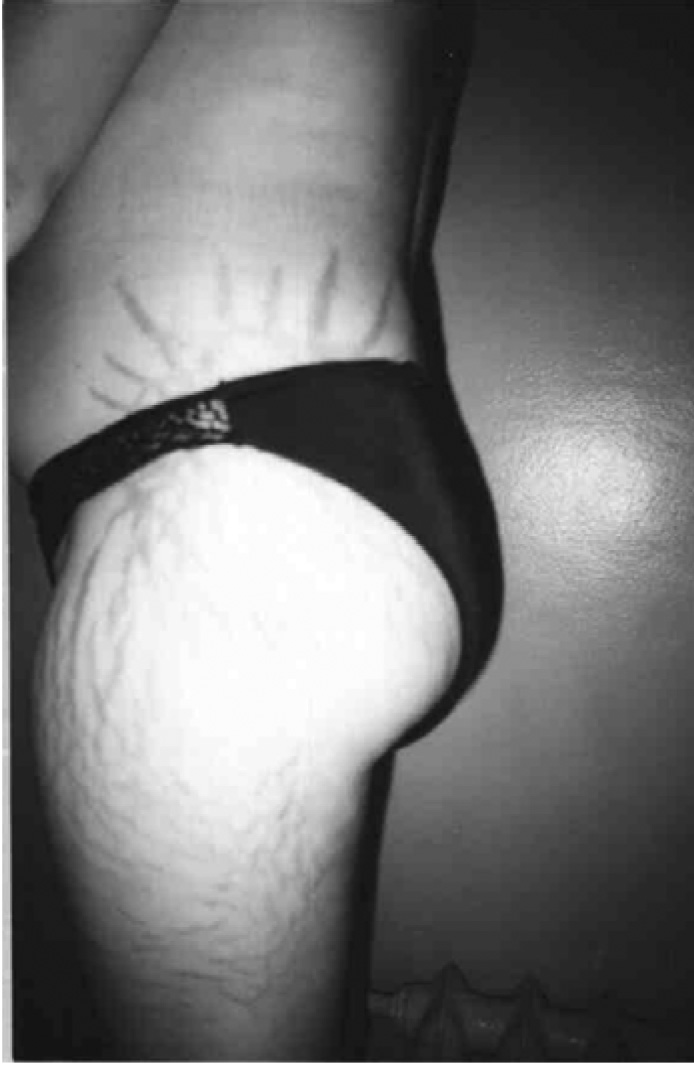
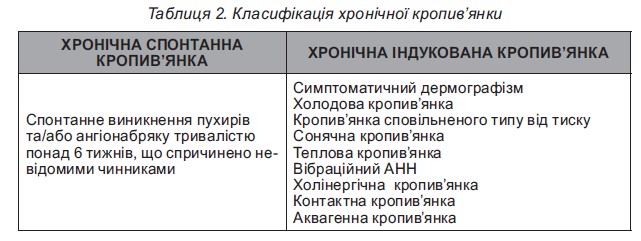 Дермографізм (писати на шкірі) найчастіше зустрічається в практиці лікаря. Його легко діагностувати шляхом подряпування шкіри тупим предметом, після чого з’являється уртикарна реакція. Припускають, що травма механічно індукує IgE-опосередковану відповідь за рахунок вивільнення гістаміну з опасистих клітин.
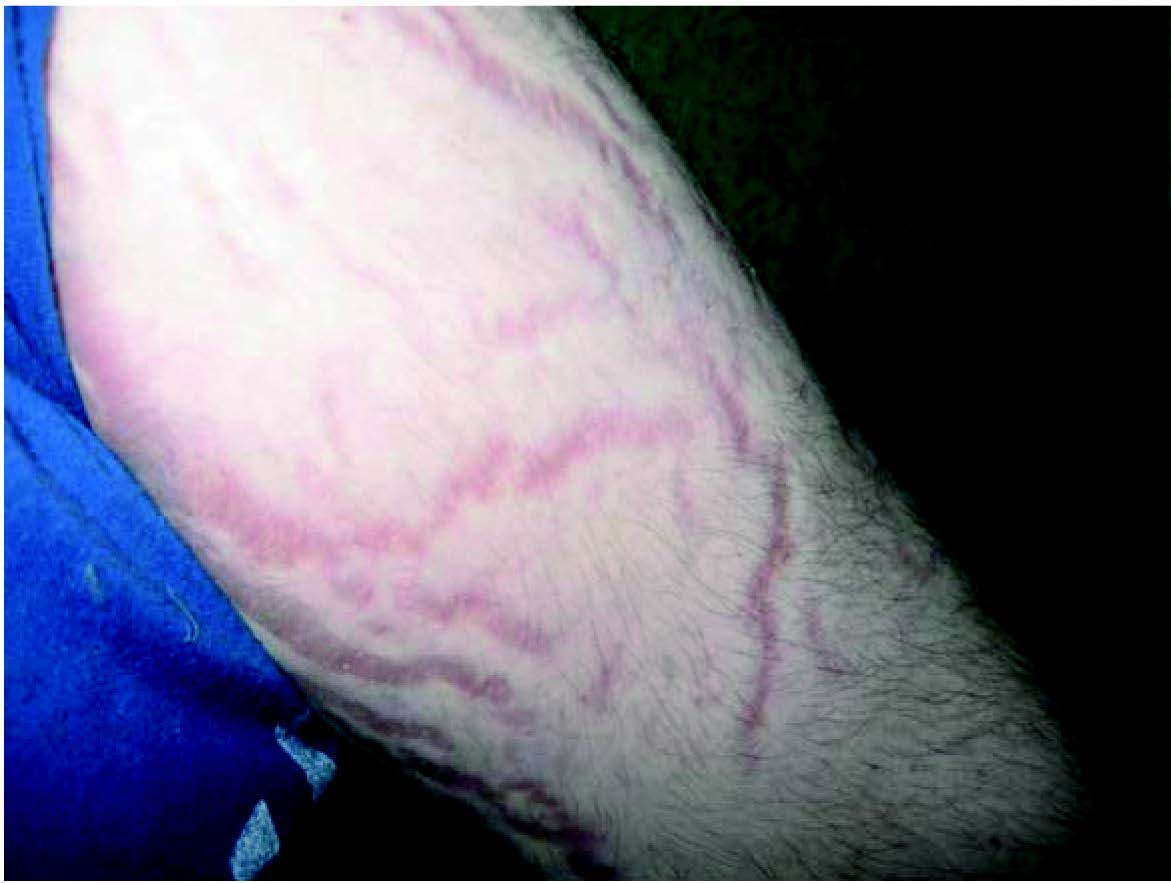
Дермографізм (писати на шкірі) найчастіше зустрічається в практиці лікаря. Його легко діагностувати шляхом подряпування шкіри тупим предметом, після чого з’являється уртикарна реакція. Припускають, що травма механічно індукує IgE-опосередковану відповідь за рахунок вивільнення гістаміну з опасистих клітин.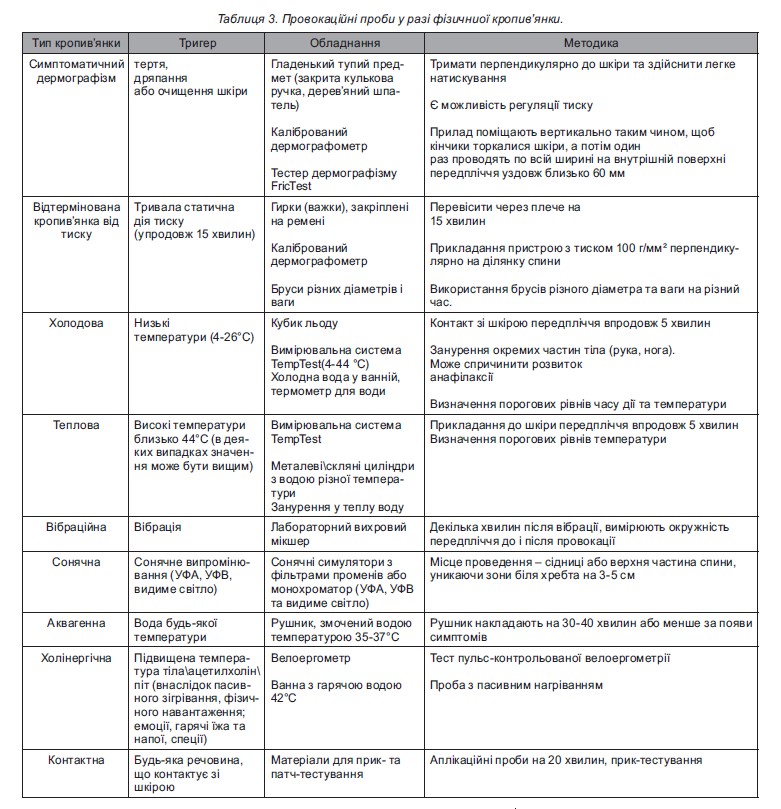 Вібраційна кропив’янка (ангіонабряк) – форма ангіонабряку (частіше, ніж кропив’янки), яка виникає у відповідь на дію вібрації (хропіння, їзда на велосипеді, дія стоматологічного бура, перфоратора та ін.). Провокаційні проби відображено в таблиці 3.
Вібраційна кропив’янка (ангіонабряк) – форма ангіонабряку (частіше, ніж кропив’янки), яка виникає у відповідь на дію вібрації (хропіння, їзда на велосипеді, дія стоматологічного бура, перфоратора та ін.). Провокаційні проби відображено в таблиці 3. Наступним кроком у діагностиці причин хронічної спонтанної кропив’янки є визначення ролі інфекції. Роль інфекційних факторів не до кінця вивчена і є предметом подальших наукових досліджень, що заявлені EAACI/ GA²LEN. У дітей це особливо актуально, оскільки саме в дитинстві людина знайомиться з більшістю інфекційних агентів. Але частота та значущість тієї чи іншої інфекції значно варіюють в залежності від географії та особливостей харчування пацієнта. Так, один із гельмінтів Anisakis simplex є причиною рецидивного перебігу кропив’янки у тих пацієнтів, що споживають морську рибу у сирому вигляді [11,12]. Загалом, чинниками можуть бути найпростіші, гельмінти, бактерії, віруси чи гриби. На сьогодні у світі ідентифіковано близько 400 видів гельмінтів, що можуть уражати людину. Серед усіх гельмінтозів, зареєстрованих в Україні у 2011р., 90% зустрічаємо у педіатричній практиці. Звісно, що наявність не всіх із них ми можемо зафіксувати об’єктивними методами, доступними сучасній медицині. Тому важливо знати особливості клінічної картини, яка може спостерігатися у разі гельмінтозу. І врешті решт, терапія ex juvantibus має право на існування: якщо після ерадикаційного лікування висип не має рецидиву, з високою вірогідністю можна говорити про те, що пацієнт був інфікований [13]. Серед бактеріальних агентів найбільш вивченою є Helicobacter pylori, участь інших не доведена у добре організованих дослідженнях, але зустрічаються описання клінічних випадків, у яких доведена ефективність ерадикаційної терапії. Наприклад, у пацієнтів із наявними ознаками тонзилярної інфекції призначення антибактеріальної терапії або тонзилектомія призводили до зникнення епізодів кропив’янки. Серед вірусів найбільше значення мають віруси групи герпесу (Епштейна-Барр віруси, герпес 6-го типу), віруси гепатитів В і С, парвовірус В19, норовірус. Є поодино кі дослідження у дорослих пацієнтів із хронічною кропив’янкою та поверхневою дерматофітією, у яких поліпшення перебігу відбулося після курсу протимікробних препаратів [14]. Тому питання щодо супутніх інфекцій мають бути з’ясовані під час огляду пацієнта, після цього можливе призначення специфічної діагностики. Для кращого уявлення про них ми згрупували літературні дані у таблицю (таблиця 5).
Наступним кроком у діагностиці причин хронічної спонтанної кропив’янки є визначення ролі інфекції. Роль інфекційних факторів не до кінця вивчена і є предметом подальших наукових досліджень, що заявлені EAACI/ GA²LEN. У дітей це особливо актуально, оскільки саме в дитинстві людина знайомиться з більшістю інфекційних агентів. Але частота та значущість тієї чи іншої інфекції значно варіюють в залежності від географії та особливостей харчування пацієнта. Так, один із гельмінтів Anisakis simplex є причиною рецидивного перебігу кропив’янки у тих пацієнтів, що споживають морську рибу у сирому вигляді [11,12]. Загалом, чинниками можуть бути найпростіші, гельмінти, бактерії, віруси чи гриби. На сьогодні у світі ідентифіковано близько 400 видів гельмінтів, що можуть уражати людину. Серед усіх гельмінтозів, зареєстрованих в Україні у 2011р., 90% зустрічаємо у педіатричній практиці. Звісно, що наявність не всіх із них ми можемо зафіксувати об’єктивними методами, доступними сучасній медицині. Тому важливо знати особливості клінічної картини, яка може спостерігатися у разі гельмінтозу. І врешті решт, терапія ex juvantibus має право на існування: якщо після ерадикаційного лікування висип не має рецидиву, з високою вірогідністю можна говорити про те, що пацієнт був інфікований [13]. Серед бактеріальних агентів найбільш вивченою є Helicobacter pylori, участь інших не доведена у добре організованих дослідженнях, але зустрічаються описання клінічних випадків, у яких доведена ефективність ерадикаційної терапії. Наприклад, у пацієнтів із наявними ознаками тонзилярної інфекції призначення антибактеріальної терапії або тонзилектомія призводили до зникнення епізодів кропив’янки. Серед вірусів найбільше значення мають віруси групи герпесу (Епштейна-Барр віруси, герпес 6-го типу), віруси гепатитів В і С, парвовірус В19, норовірус. Є поодино кі дослідження у дорослих пацієнтів із хронічною кропив’янкою та поверхневою дерматофітією, у яких поліпшення перебігу відбулося після курсу протимікробних препаратів [14]. Тому питання щодо супутніх інфекцій мають бути з’ясовані під час огляду пацієнта, після цього можливе призначення специфічної діагностики. Для кращого уявлення про них ми згрупували літературні дані у таблицю (таблиця 5).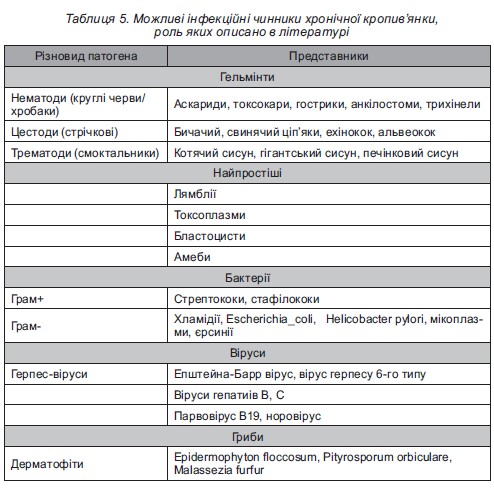 Лабораторна діагностика
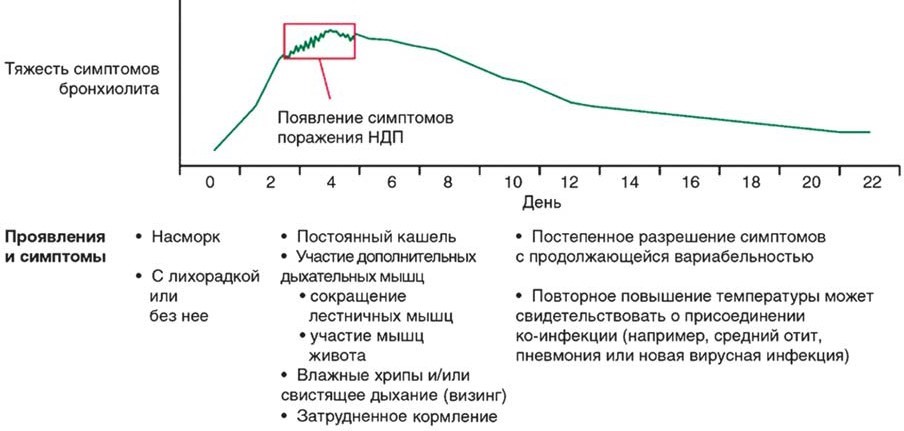
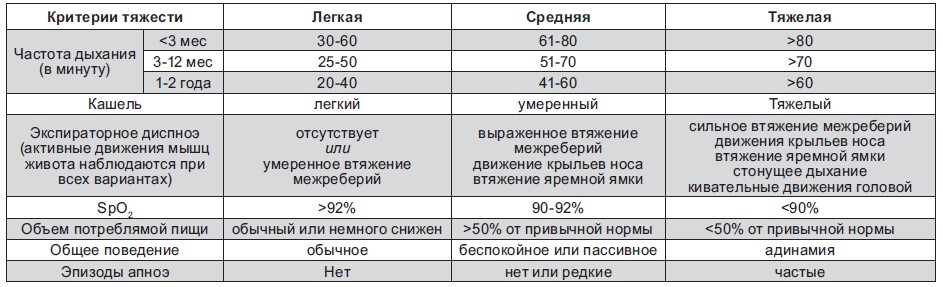
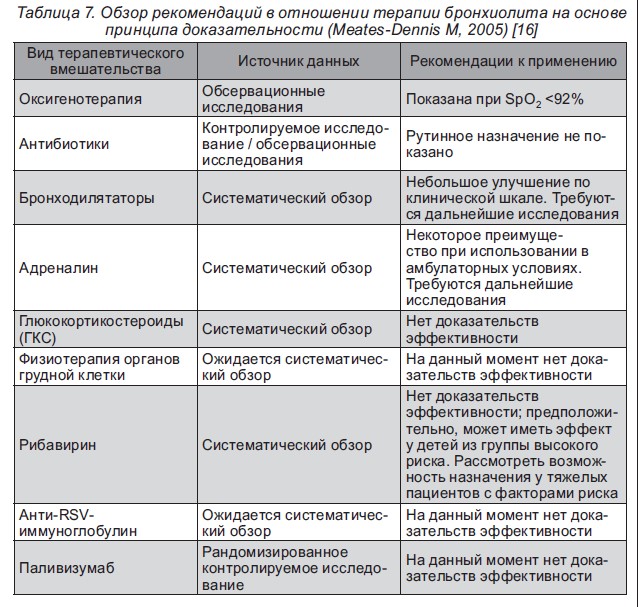
Лабораторна діагностика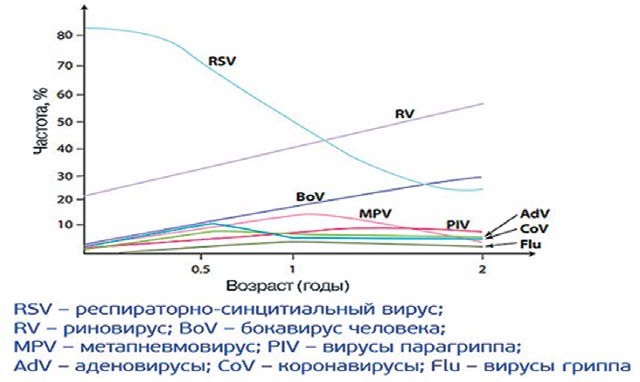
Останні коментарі